Сабақтың тақырыбы: Резерфорд тәжірибесі. Атомның құрамы. Атомның моделі
Сабақтың мақсаты:
Білімділік:
Радиактивтік құбылысы және радиактивтік сәулелер жайлы білімдерін бекіту, оқушылардың ғылыми дүниетанымдық көзқарастарын физикалық үрдіс барысында қалыптастыру.
Атом туралы бейнелік көзқарас қалыптасыруда химиядан алған білімдерін синтездеу.
Оқушыларға Резерфорд тәжірибесін (тәжірибе қондырғысын, барысын, нәтижесін) атомның планетарлық моделін түсіндіру, Резерфорд тәжірибесін өздігінше түсіндіріп айта білуге ықпал жасау.
Дамытушылық:
Ойлау, құбылыстар мен заңдылықтарға талдау жасау, салыстыру, логикалық тұжырым жасау қабілеттерінін дамыту.
Тәрбиелік:
Резерфорд тәжірибесін түсіндіру, тапсырмалар орындау барысында оқушыларды шапшаңдыққа, жинақылыққа тәрбиелеу, пәнге қызығушылығын арттыру.
Сабақтың типі: Жаңа материалды игерту
Сабақтың түрі: Аралас сабақ
Сабақтың әдісі: Түсіндіру, сұрақ-жауап, практикалық.
Пәнаралық байланыс: Химия, математика
Сабақтың көрнекілігі: мультимедиялық подиум, флипчарт, таратпа материалдар, Менделеев кестесі, сызба-суреттер
Сабақтың барысы:
І. Ұйымдастыру кезеңі:
Оқушылармен амандасу, түгелдеу
Сабаққа дайындығын қадағалау
Назарларын сабаққа аудару
ІІ. Білімдерін жан-жақты тексеру:
Жылулық сәулелену
Абсолют қара дене
Стефан-Больцман заңы
Планк гипотезасы
Фотоэффект
Рентген сәулелері
Рентген сәулелерінің медицинада қолданылуы
Фотон деген не? Оның массасы, тыныштықтағы массасы.
ІІІ. Жаңа материалды игертуге дайындық:
Бізді қоршаған ортада сансыз мол әр түрлі табиғи заттар мен денелер бар. Қолдан
жасалған көптеген жасанды бұйымдар да жетерлік. Әлемдегі әр түрлі денелер, жер бетіндегі, мұхиттар мен теңіздердегі сан алуан өсімдіктер мен жан-жануарлар қаншама?! Міне осындай «тірі табиғат» пен «өлі» табиғаттағы сан жетпес әр түрлі заттар мен денелер неден тұрады деген сұрақ туады.
Ғылыми-зерттеулер жоғарыдағы сұрақтың нақты жауабын тапты. Ертедегі грек ғалымдары барлық заттар бөлінбейтін өте ұсақ кішкентай бөлшектерден тұрады деп жорамалдаған болатын. Демокрит ондай бөлшектерді атомдар деп атады. (Атом – «бөлінбейді» деген мағынаны береді). Атомдық теория ХҮІІІ ғасырда жаңа қарқын алып дами бастады. М.В.Ломоносов, А.Лавуазье, Д.Дальтон және басқа ғалымдардың еңбектерінде атомдардың бар екені нақты дәледенді. Бұл кезде де атомдар одан әрі бөлшектенбейді деп есептелді.
Бірақ физика ғылымының дамуы барысында, ХІХ ғасырдың аяғына қарай атомдар бөлінбейтін қарапайым бөлшек емес, онық құрамы күрделі болуы тиіс деген ойлар туа бастады. Бұл жерде 1869 жылы Д.И.Менделеевтің химиялық элементтер қасиеттерінің периодты түрде қайталану заңын ашуы, яғни элементтердің периодтық кестесін жасауы үлкен рөл атқарды. Егер атомды күрделі бөлшек деп есептесек, атомдық масса өскен сайын элементтер қасиеттерінің периодты түрде қайталануымен түсіндіруге болар еді.
Өткен сабақта біз атомның күрделі құрылысын айғақтайтын құбылысты қарастырған болатынбыз.
Сұрақ:
1896 жылы Беккерель қандай құбылысты байқады?
Кейбір химиялық элемент атомдарының өз-өзінен сәуле шығаруы қалай аталады?
Радиактивті сәулелену құрамына кіретін бөлшектер қалай аталады?
Осы бөлшектер ненің ағыны?
ІҮ.Жаңа материалды меңгерту:
Атомдық теорияны жақтаушылар атом ең ұсақ бөлшек, ол бөлінбейді деп қарастырған болатын. Бірақ атом құрылысының күрделі екендігі физикалық айғақтармен дәлелдеді. Адамдар атомның күрделі бөлшек екендігін, табиғатта одан да кіші бөлшектредің бар екендігін түсінді.
Атомнан кіші қандай бөлшектерді білесіңдер? (электрон, протон, нейтрон)
Атомның күрделі бөлшек екендігін анықтаған соң ғалымдар оның әртүрлі теориялық моделдерін ұсынды. Атомның алғашқы модельдерінің бірін 1903 ж Дж.Томсон ұсынды. Бұл үлгіде атом радиусы 10-10м оң зарядталған шар ретінде қарастырылады. Шардың ішінде тепе-теңдік жағдайының маңында электрондар тербеліп тұрады. Электрондардың теріс зарядтарының қосындысы шарға біркелкі таралған оң зарядты теңестіреді, сондықтан тұтас алғанда атом электр бейтарап бөлшек болады. Кейінгі зерттеулер бұл модельдің дұрыс емес екенін көрсетті, сондықтан Томсон моделі қазір тек тарихи тұрғыдан қарастырылады.
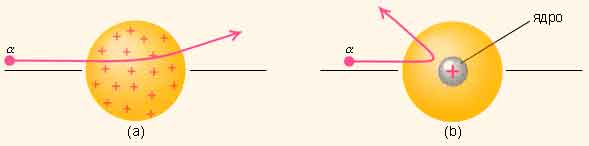
Атомның ішінде электр зарядтарының орналасу тәртібін анықтау үшін 1911 жылы Резерфорд өзінің шәкірттері Г.Гейгер және Марсденмен бірге тәжірибе жасады. Резерфорд жасаған тәжірибені қарастырып көрейік. Қорғасыннан жасалаған контейнердің түбіне Альфа бөлшектер шығаратын радиактивті Радий элементін орнласқан. Альфа бөлшектері өзекше (қалған альфа бөлшектерін қорғасын жұтып алады) тарала отырып фольганы соққылайды.

Фольгадан өткен альфа бөлшектерді экран тіркеп отырады. Резерфорд альфа бөлшектерінің ауытқымай бірден фольгадан өтіп кетітінін байқады. Алайда, альфа бөлшектерінің аз бөлігінің 900 –тан артық бұрышқа ауытқуы, яғни олар фольгаға соғылып кері бағытта ұшатыны таңдандырды. Сегіз мыңға жуық бөлшектердің біреуі ғана осындай үлкен бұрышқа ауытқиды екен. Резерфорд оң зарядталған альфа бөлшектерінің өз бағытынан ауытқуы, оның жолында оң зарядталған «бір нәрсемен» кездесуінен деп түсіндірді. Бұл ядро болатын. Ядро оң зарядталған, оның радиусы 10-15м. Атомның массасы түгел дерлік ядроға шоғырланған. Оны айнала әртүрлі орбитамен теріс зарядталған электрондар қозғалып жүреді. Ең шеткі электрон орбитасының радиусы атомның радиусына тең. Бұл үлгі Күн жүйесінің құрылымына ұқсайтындықтан оны атомның планетарлық моделі деп атады. Модель бойынша атом көлемінің басым көпшілігі «бос» болып шығады, ядроның радиусы атомның радиусынан 100 000 есе кіші
Басқаша айтқанда атом массасы түгелімен ядрода жинақталған деуге болады. Сөйтіп, альфа бөлшектері фольгадан өткенде өз жолында электрондармен және ядромен кездеседі. Электрондармен кездескен альфа бөлшектері өз бағытын өзгертпей тура таралатын болса, ядромен кездескен альфа бөлшектері өз бағытын 1350 - 1500 өзгертеді екен. Алайда соңғыларының саны онша көп емес. Орта есеппен алғанда 8000 альфа бөлшектің тек біреуі ғана өз бағытын 1500 өзгертеді, (сурет). Атом күрделі жүйе, оның центрінде оң зарядталған ядро бар, оның заряды +Ze (мұндағы Z –элементтің реттік нөмірі). Ядроны айнала электрондар қозғалып жүреді, қалыпты күйде олардың саны Z-ке тең. Резерфорд мрделі атом құрылысын дұрыс түсіндіре білді.
Ядро атом көлемінің өте кішкене орталық бөлігін алып тұрады. Ядроның диаметрі 10-12 – 10-13 см, ал атомның диаметрі 10-8 см шамасында. Егер атомның көлемін футбол алаңының аумағына дейін үлкейтетін болсақ. Атом ядросының көлемі футбол алаңында түсіп қалған шие дәніндей ғана болар еді.
Атомдар қалыпты жағдайда бейтарап болатындықтан, электрондардың заряды мен ядроның заряды бірін-бірі теңгеріп тұрады.
Ғалымдардың зерттеуі бойынша атом ядроларының заряды
qя= +Z*e
Ядроның құрамына кіретін оң зарядты бөлшектерді протондар деп атайды.
Кез келген элемент атомының ядросындағы протондар саны сол элементтің Менделеев кестесіндегі реттік санына тең.
Ядродағы пртотондар мен нейтрондардың жалпы саны А әрпімен белгіленеді. Ол массалық сан деп атайды.
![]()
Массалық сан мен заряд санын біле отырып, ядродағы нейтрондар санын таба аламыз:
![]()
Бір-бірінен тек ядросындағы нейтрондар санына қарай ажыратылатын элемент түрлерін изотоптар деп атайды.
Ү. Жаңа материалды бекіту:
Атомның планетарлық моделін кім жасаған? (Резерфорд)
Зат неден тұрады? (молекула, атом, протон, нейтрон, электрон)
Атом дегеніміз не? (Бөлінбейтін бөлшек)
Атом заряды қандай? (бейтарап)
Ядроны құрайтын бөлшек туралы не білесің? (протон-оң, нейтрон- нейтрал)
Заттың агрегаттық күйлерінің ерекшеліктерін ата.
Өмірден мысалдар келтіру.
ІІ. Енді Менделеев кестесін ашып, оған мұқият қарайық.
Сутегі, гелий, литий, бериллий элементтерінің атомының құрылысын қарастырайық.
Күміс және Менделевий ядроларының құрамы қандай?
He, Li, Be атомдарында қанша электрон бар?
4 2Х; 197 79Х; ![]() 26Х56 ядроларының қандай элементтікі екенін анықта.
26Х56 ядроларының қандай элементтікі екенін анықта.
1Р1; 2Не4; -1е0; 1Н2 белгілеулерінде қандай бөлшектер мен атомдар ядролары көрсетілген.
ҮІ. Оқушыларды бағалау:
ҮІІ. Үй тапсырмасын беру: 53 оқу, 42-жаттығу шығару. Э.Резерфорд өмірі жайлы реферат

Жақсы
жақсы құрылған
рахмет
жақсы сабақ жоспары
жақсы